Im Praktikum in Analytischer Chemie während meines ersten Semesters an der Universität musste ich viel titrieren. Wenn ich daran zurückdenke, erinnere ich mich an das sorgfältige Dosieren von Titriermittel mit der Glasbürette, das umständliche Nachfüllen der Bürette und den ständigen Verdacht, den Endpunkt nicht richtig gewählt zu haben.
Jeder im Praktikum erzielte ständig unterschiedliche Ergebnisse – aber wir waren uns nie ganz sicher, warum. Damals war ich noch nicht so erfahren wie heute. Heute, nach 10 Jahren Erfahrung in der Titration, habe ich gelernt, dass die Ergebnisse der manuellen Titration sehr stark von der Person abhängen, die sie durchführt. Hier sind die wichtigsten Fehlerquellen bei der manuellen Titration und wie man sie vermeiden kann.
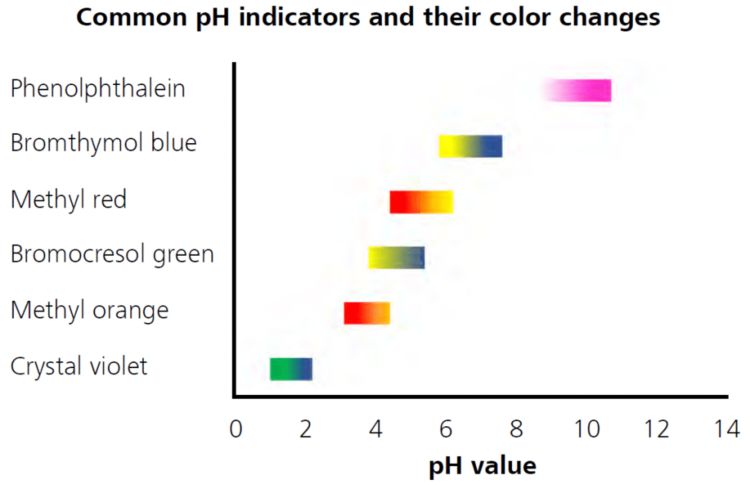
Tabelle 1: Die Wahl des richtigen Indikators
Sicher haben auch Sie irgendwann im Ihrer Ausbildung gelernt, dass der pH-Wert des Titrationsendpunkts von der Säuredissoziationskonstante (Ka) der verwendeten Säure und Base abhängt:.
Wenn eine starke Base mit einer starken Säure titriert wird, liegt der pH-Wert am Endpunkt bei etwa 7.
Bei der Titration einer starken Base mit einer schwachen Säure verschiebt sich der Endpunkt in den alkalischen Bereich.
Die Titration einer starken Säure mit einer schwachen Base führt zu einem Endpunkt im sauren Bereich.
Dies erklärt, warum bei Säure-Base-Titrationen mehrere verschiedene Indikatoren verwendet werden. Doch welcher ist der Richtige?
Tabelle 1 zeigt einige der am häufigsten verwendeten pH-Indikatoren. Sie können sich wahrscheinlich vorstellen, dass Sie keine korrekten Ergebnisse erhalten, wenn der pH-Wert Ihres Endpunkts bei etwa 7 liegt, Sie aber Kristallviolett oder Methylorange als Indikator verwenden. Glücklicherweise ist in den meisten Standards und SOPs ein geeigneter Indikator angegeben. Befolgen Sie die Anweisungen, und Sie sind auf der sicheren Seite!

Endpunkt-Erkennung ist subjektiv
Die Probleme fangen erst
richtig an, wenn Sie versuchen, den Endpunkt zu erkennen. Haben Sie
jemals über die Nuancen des Farbwechsels nachgedacht?
In Abbildung 1 bis 5 oben sehen Sie fünf Stufen einer Säure-Base-Titration von c(HCl) = 1 mol/L mit c(NaOH) = 1 mol/L gegen Phenolphthalein als Indikator. Der Umschlag erfolgt bekanntermaßen von farblos nach rosa. Der einzige Unterschied zwischen jedem nachfolgenden Bild und seinem Vorgänger besteht in einem zusätzlichen Tropfen Titriermittel. Wo würden Sie in diesem Fall den Endpunkt sehen?
Ist der Endpunkt in Abbildung 1 erreicht, wo nur ein schwaches Rosa zu sehen ist? Oder ist er in Abbildung 3 erreicht, wo die Farbe intensiver wird? Oder erst in Abbildung 5, wo die rosa Farbe am intensivsten ist? Zwischen Abbildung 1 und Abbildung 5 wurden nur vier Tropfen Titriermittel zugegeben. Bei der pharmazeutischen Definition eines Tropfens als ein Volumen von 50 µL entspricht dies 200 µL Titriermittel oder etwa 7,3 mg Salzsäure - ein deutlicher Fehler.
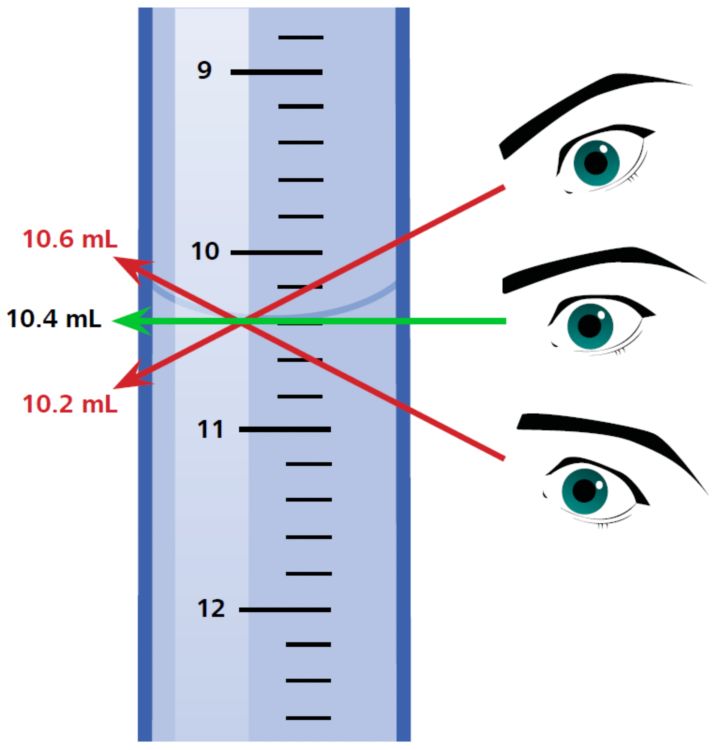
Ablesen des Bürettenvolumens
Erinnern Sie sich, wie man die Bürette richtig liest? Sie müssen genau darauf achten, dass Sie den Meniskuswert horizontal ablesen. Warum?
Der Volumenwert hängt vom Winkel ab, aus dem Sie die Bürette betrachten. In Abbildung 6 gezeigten Fall weichen die Ablesewerte je nach Blickwinkel bis zu 0,2 mL (200 µL) vom tatsächlichen Wert ab. Je mehr Ihre Blickrichtung von der Horizontalen abweicht, desto ungenauer ist die Messung damit das Ergebnis. Sie können von einem durchschnittlichen Fehler von 200 µL ausgehen. Das ist ziemlich viel für eine Titration, wie ich im vorherigen Beispiel gezeigt habe!
Verbesserung der Objektivität und Genauigkeit
Wie können Sie diese Fehler beseitigen? Der am einfachsten zu behebende Fehler ist der Ablesefehler. Die Lösung hierfür ist eine elektronische Bürette. Wenn Sie eine solche verwenden, müssen Sie diese lediglich mit dem Titriermittel füllen und dann einen Knopf drücken. Das Gerät dosiert das Titriermittel und misst automatisch dessen Volumen und zeigt Ihnen dieses digital an. Schon der Einsatz einer preiswerten elektronischen Bürette bewirkt eine deutlich höhere Objektivität Ihrer Ergebnisse.
Das verbessert zugleich die Genauigkeit Ihrer Ergebnisse. Ich brauche Ihnen sicher nicht zu sagen, wie wichtig Genauigkeit in der analytischen Chemie ist. Stellen Sie sich beispielsweise vor, Sie haben bei einer Probe einen Goldgehalt von 90% gefunden, aber in Wirklichkeit liegt der Goldgehalt bei 99 %. Durch diese Fehleinschätzung könnten Sie viel Geld verlieren, wenn Sie Ihr Gold verkaufen wollten!
Zuvor habe ich gezeigt, dass die visuelle Endpunkterkennung mithilfe eines Farbindikators zu Fehlern von bis zu 200 µL führen kann. Eine ungenaue Bürettenablesung kann zu einem zusätzlichen Fehler von 200 µL führen. Die Verwendung einer elektronischen Bürette trägt zwar nicht zu einer objektiveren Endpunkterkennung bei, verringert jedoch die minimale Volumenzugabe pro Tropfen: Sie beträgt nicht mehr bis zu 50 µL, sondern kann je nach verwendetem Zylindervolumen soar nur 0,25 µL betragen. Dadurch wird der Fehler bei der Endpunkterkennung erheblich verringert. Die folgenden Mindestvolumenzusätze sind üblich:
| Zylindervolumen (ml) | Mindest. Volumenaddition (µL) |
| 5 | 0.25 |
| 10 | 0.50 |
| 20 | 1.00 |
| 50 | 2.50 |
Der nächste Schritt: Automatisierte Titration
Wenn Sie alle in diesem Beitrag beschriebenen Fehlerquellen beseitigen wollen, müssen Sie zur automatischen Titration oder Autotitration übergehen. In diesem Fall verwenden Sie einen chemischen Sensor, um die pH-Änderung in der Probe zu messen, und einen mathematischen Algorithmus, um den Endpunkt zu interpolieren – ein Indikator ist nicht mehr erforderlich. Darüber hinaus haben Sie die gleiche Präzision wie bei der elektronischen Bürette.
Weitere Informationen finden Sie in unserem entsprechenden Blogbeitrag.
So übertragen Sie die manuelle Titration auf die Autotitration
Fünf Gründe, von der manuellen zur automatisierten Titration zu wechseln
Ihr Wissen zum Mitnehmen
Manuelle vs. automatisierte Titration: Vorteile und Vorzüge des Wechsels
 Artikel teilen
Artikel teilen
